文献解读 | 机械应力依赖的自噬成分通过肿瘤细胞内的细胞外纳米囊泡释放


文章信息
期刊:ACS nano
影响因子(IF):13.709
文章名称:Mechanical Stress-Dependent Autophagy Components Release via Extracellular Nanovesicles in Tumor Cells(点击获取全文)
作者:王凯喆博士
作者单位:中国科学院上海应用物理研究所
引用抗体:Anti-ATG7|bs-2432R
Goat Anti-Rabbit IgG antibody/HRP|bs-0295G-HRP
Goat Anti-Mouse IgG antibody/HRP|bs-0296G-HRP
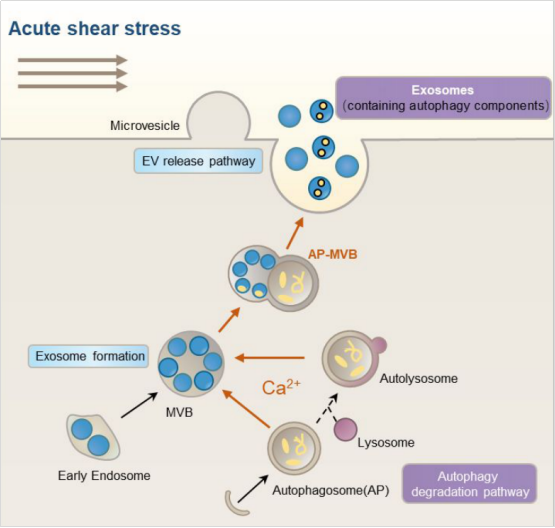
肿瘤细胞通过血液或淋巴系统转移必须承受急性流体剪切力(ASS)作用。自噬是一种细胞存活机制,在应激条件下发挥作用,但也促进细胞死亡或凋亡。在ASS作用下,我们预测肿瘤细胞存在自噬的代偿通路。我们发现,ASS促进自噬体的积累,诱导含有自噬成分的细胞外囊泡EVs释放。此外,文章发现,ASS促进多泡体小体(MVB)与自噬体融合形成AP-MVB复合物,然后通过EV-MVB-exosome途径诱导自噬成分释放到细胞外。更重要的是,无论是增加细胞内自噬体的积累,还是抑制自噬降解,均促进AP-MVB的积累,但均未诱导自噬相关蛋白通过EVs释放,除非在ASS条件下。这说明EV-MVB-exosome通路是机械依赖的代偿通路。综上所述,本实验发现EVs为肿瘤细胞提供了额外的一层保护,并与自噬协同在机械应激条件下维持细胞的稳态。
• Bioss被引用产品
文中,通过siRNA降低ATG7表达,进而降低细胞内自噬水平。通过western blot利用Bioss公司ATG7(bs-2432R)抗体验证siRNA ATG7敲除效果。ATG7表达降低后,检测到胞内自噬水平的降低,进而检测到胞外EVs中自噬相关蛋白的降低,为文章结论提供了支撑。
(感谢王凯喆博士提供素材!)
![]() Bioss相关抗体
Bioss相关抗体![]()