![]()

小B带您继续回顾Bioss产品 2020年文献引用高光时刻,供大家了解最新科研进展以及Bioss产品的应用,愿与您共同书写2021年的新篇章,再续辉煌!
PS:各文献主要研究成果见下文
Nature Medicine【IF=36.13】
文中引用Bioss抗体
Anti-MerTK/Cy3|bs-0548R-Cy3|IHF 1:100

TREM2(绿)及巨噬细胞标志物CD68(红)在健康滑膜(a)、活动性RA滑膜(b)及持续缓解期RA患者滑膜(c) IF检测
TRE-M2posCD68pos巨噬细胞 (白色实心箭头)和TREM2negCD68pos巨噬细胞(白色空心箭头);内嵌图展示高倍的TREM2posCD68pos细胞;细胞核DAPI染色 (绿);A代表脂肪细胞;健康滑膜(n=5)、活动性RA滑膜(n=6)及持续缓解期RA患者滑膜(n = 6)图片在3次独立实验中均获得类似结果;比例尺50 μm。作者对依据scRNA-seq分类的STMs进行IF检测,研究发现MerTKposTREM2pos STMs在健康滑膜内及持续缓解期RA患者滑膜内均形成一个完整的衬层,但在活动性RA滑膜中这一衬层并不完整。为证实MerTKneg STM和MerTKpos STM的临床异质性提供了有力依据,为作者最终结论的获得提供了部分临床数据。
Nature Medicine【IF=36.13】
药物超敏反应综合征[drug-induced hypersensitivity syndrome(DIHS) or drug reaction witheosinophilia with systemic symptoms(DRESS), DiHS/DRESS]是一种由有限特定药物引起、累及多器官系统、威胁生命的重症药疹,与疱疹病毒再活化及随后自身免疫疾病发作相关。由于其病理生理学仍然难以捉摸,治疗选择有限。美国国立卫生研究院Keisuke Nagao博士团队采集了SMX-TMP[sulfamethoxazole(SMX)和trimethoprim(TMP)]诱导的DiHS/DRESS患者以及健康志愿者的样本,基于单细胞RNA测序(scRNA-seq)探讨了DiHS/DRESS的潜在相关通路和潜在靶点。scRNA-seq为缺乏动物模型的DiHS/DRESS提供了前所未有的剖析疾病病理生理学的机会,并为个性化医学提供一种替代方法。文中引用Bioss抗体
Anti-JAK3|bsm-54067R|IHF 1:100
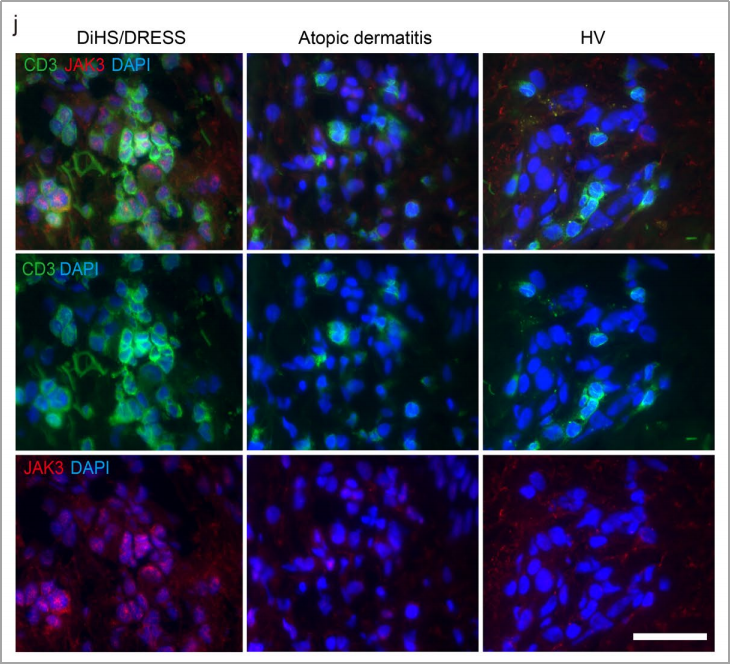
IF检测DiHS/DRESS皮肤浸润CCR10+CD3+T细胞及JAK3表达,结果显示在DiHS/DRESS中JAK3的显著表达,为证实皮肤浸润淋巴细胞中JAK-STAT信号通路活跃提供了有力依据。
Cancer Discovery【IF=29.497】
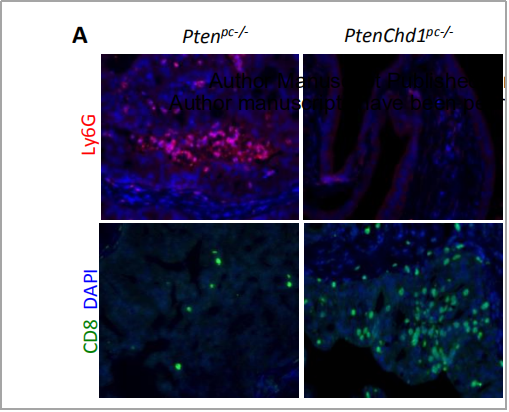
前列腺癌多发抑癌基因PTEN失活,并伴有较差预后。美国德克萨斯大学安德森癌症中心Ronald A. DePinho教授、Y. Alan Wang副教授及其团队先前研究证实染色质解旋酶DNA结合因子(CHD1)可以作为PTEN缺失的前列腺癌的必需基因。为进一步探索相关的体内遗传证据并了解其作用机制,研究者们建立了Pten和Pten/Smad4基因工程小鼠模型,发现前列腺CHD1特异性缺失可显著延缓肿瘤进展并延长癌症模型的生存期。Chd1缺失与肿瘤微环境(TME, tumor microenvironment)重塑相关,伴随着MDSCs减少,CD8+ T细胞增加。CHD1在PTEN缺失的前列腺癌中驱动免疫抑制,重塑免疫抑制TEM。进而发现IL-6是CHD1的关键转录靶点,在招募髓源免疫抑制细胞(MDSCs)中起重要作用。鉴于MDSCs在抑制免疫检查点抑制剂(ICI, immune checkpoint inhibitors)方面的突出作用,研究结果为抗IL-6和ICI疗法联合检测,尤其在PTEN缺失前列腺癌治疗中突破TME,克服免疫疗法耐药提供了依据。
文中引用Bioss抗体
Anti-CD8|bs-0648R|IHF&IHC
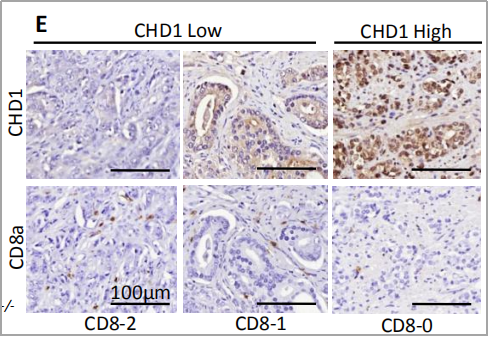
人前列腺癌CHD1和CD8a的IHC检测
(n=72;r=-0.273;p=0.02;CHD1表达:低到高;CD8值:0-2;比例尺:100μm)
Cancer Discovery【IF=29.497】
胰腺导管腺癌(PDAC, pancreatic ductal adenocarcinoma)的一个特征是特殊的间质组成,含多种类型细胞,可促进或抑制肿瘤进展。美国德克萨斯大学安德森癌症中心Ronald A. DePinho教授及其团队探讨了致癌基因Kras在介导肿瘤细胞和宿主细胞的相互作用的致瘤信号中的作用。研究表明,Kras*(致癌基因KRAS突变)驱动癌细胞中I型细胞因子受体复合物(IL2rγ-IL4r⍺和IL2rγ-IL13r⍺1)的自主表达,而这些复合物又能够接收肿瘤微环境中TH2细胞产生的细胞因子生长信号(IL4或IL13)。早期肿瘤病变显示Kras*癌细胞紧挨分泌IL4和IL13的TH2细胞。Kras*主要通过Jak1-Stat6通路激活IL2rγ-IL4r⍺和IL2rγ-IL13r⍺1受体信号,促进癌细胞增殖和肿瘤生长。作者们利用转录组学、染色质免疫共沉淀和代谢组学研究论证了cMyc作为激活Stat6的直接靶点,驱动糖酵解。因此,肿瘤微环境中的旁分泌信号在Kras*驱动的PDAC代谢重编程中发挥关键作用。证实了PDAC中KRAS利用肿瘤微环境中的细胞因子驱动代谢重编程,为探索基于癌症特征的胰腺癌治疗提供了途径。文中引用Bioss抗体
Anti-IL4R|bs-2458R|IHC

IHC检测结果显示与正常组织相比,约95%的PDAC存在不同程度的IL2Rγ和IL4R过表达,与Kras*表达一致,佐证了PDAC中Kras*上调表达IL2Rγ和IL4R。
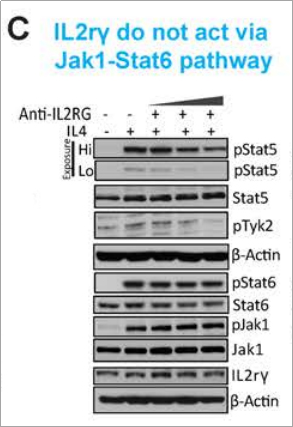
中和抗体抑制IL2rγ后Jak1表达和Stat6的磷酸化无改变,p-Tyk2 和p-Stat5适度减少, 证实IL4信号利用Tyk2-Stat5通路经由IL2rγ-IL4r受体途径而利用Jak1-Stat6通路经由IL13R 1-IL4R途径。为最终得出IL4和IL13细胞因子激活Jak1-Stat6信号通路结论提供了支撑,这也促使作者对Jak1-Stat6通路促进PDAC癌细胞存活与肿瘤发生进行进一步的功能分析。
相关产品列表
(点击图片查看大图)